La recherche clinique
Essais cliniques - Région Sud Méditerranée
Comprendre...
L’essai clinique peut porter sur un médicament, un dispositif médical, un dispositif de diagnostic ou une pratique de soins.
La recherche clinique est une activité hautement règlementée : la loi française, les règlements européens et standards internationaux encadrent tous les aspects et étapes des essais cliniques.

Les différents types d’essais cliniques
Les essais portant sur les médicaments
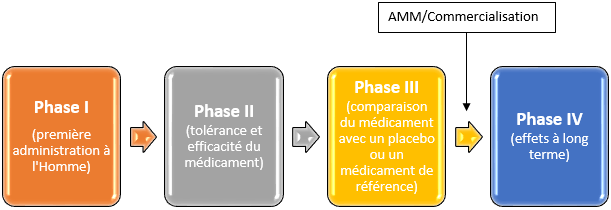
Afin de garantir la sécurité des personnes et la validité des résultats, les essais cliniques sur le médicament se déroulent en plusieurs étapes, ou Phases.
Les essais cliniques de phase I correspondent à la première administration à l’être humain d’un médicament ou aux premières études de tolérance. Ces essais sont réalisés sur un petit nombre de personnes volontaires et permettent d’évaluer la tolérance du médicament potentiel ainsi que l’absence d’effets indésirables dans le but de déterminer la dose d’administration pour les phases futures. Ils concernent généralement les volontaires sains mais peuvent aussi inclure des malades selon les types de traitements à l’étude.
Les essais cliniques de phase II évaluent la tolérance et l’efficacité d’un traitement selon la dose définie en phase I. Ils s’effectuent sur quelques dizaines de malades volontaires.
Les essais cliniques de phase III s’effectuent sur plusieurs centaines de malades. Ils permettent la comparaison du nouveau médicament soit à un placebo (substance sans principe actif), soit à un traitement de référence lorsqu’il en existe un.
Si les résultats des essais cliniques montrent une meilleure efficacité ou une meilleure tolérance du nouveau médicament, alors, le laboratoire pharmaceutique pourra demander aux autorités compétentes une Autorisation de Mise sur le Marché (AMM) qui permet la commercialisation de la molécule.
Après sa commercialisation, le médicament continue à être surveillé par les autorités de santé. C’est ce qu’on appelle les essais de phases IV. Cette phase permet notamment d’étudier les effets à long terme, d’identifier de nouveaux effets indésirables dits « rares » non observés au cours des essais précédents, d’étudier l’utilisation du traitement dans la vie de tous les jours et les éventuelles interactions avec d’autres médicaments. Ils permettent également d’étudier des médicaments dans de nouvelles indications.
Essais de phase précoce organisés en région Sud Méditerranée
Un essai clinique précoce (phase I ou II) correspond aux premières phases d’administration d’un nouveau médicament à l’Homme. Les phases précoces ont pour objectif d’évaluer la tolérance et le devenir du médicament dans l’organisme, ainsi que les éventuels effets secondaires afin de déterminer la dose recommandée (phase I), et l’efficacité de la molécule sur un effectif limité de patients (phase II). Les patients peuvent participer à un essai de phase précoce selon leur maladie et les critères spécifiques liés à l’étude. La participation à un essai de phase précoce permet au patient d’accéder, bien avant sa commercialisation, à un traitement innovant, tout en contribuant à aider à l’avancée de la recherche. Ces études de phases précoces sont réalisées dans un nombre limité de centres, respectant les critères de qualité et de sécurité demandés par les autorités.
En Provence-Alpes Côte d’Azur, l’Assistance Publique-Hôpitaux de Marseille (AP-HM), le Centre Antoine Lacassagne, le Centre Hospitalier Universitaire de Nice et l’Institut Paoli Calmettes proposent à leurs patients des essais de phase précoce.
Concernant la Cancérologie et l’Hématologie, l’Institut National du Cancer, depuis 2010, a labellisé 16 centres d’essais précoces sur le territoire national, nommés CLIP2 (Centres Labellisés INCa de Phase Précoce). Ces centres bénéficient d'un soutien logistique et financier afin de leur permettre de se hisser au plus haut niveau international de qualité dans la réalisation d’essais cliniques de phase précoce. Dans notre région, deux centres d’essais précoces ont été labellisés par l’INCa : le centre d’essais précoces Enfants / Adultes de l’AP-HM et le centre d’essais précoces Adultes de l’Institut Paoli Calmettes.
Les essais cliniques avec dispositifs médicaux
Un dispositif médical est, selon la définition de l’ANSM (Agence nationale de sécurité du médicament et des produits de santé), un instrument, appareil, équipement ou encore un logiciel destiné, par son fabricant, à être utilisé chez l’homme à des fins, notamment, de diagnostic, de prévention, de contrôle, de traitement, d’atténuation d’une maladie ou d’une blessure.
Comme les médicaments, le développement de ces dispositifs médicaux nécessite la réalisation d’essais cliniques. En revanche, contrairement aux médicaments, elles ne sont pas organisées en phases. Il existe une étude pré-marketing pour des dispositifs classiques et, pour les dispositifs plus innovants ou à risque d’un point de vue thérapeutique (par exemple le cœur artificiel), une phase pilote de premier essai sur l’homme est réalisée afin d’évaluer la contribution médico-scientifique du dispositif ainsi que sa sécurité.
Les essais cliniques ne portant ni sur des médicaments ni sur des dispositifs
Certaines études ne portent ni sur un médicament ni sur un dispositif mais vont permettre d’évaluer une technique (chirurgicale par exemple), une prise en charge (accompagnement par un pharmacien pour la prise de médicament – éducation thérapeutique) ou une pratique (effet de la pratique du sport dans la tolérance aux chimiothérapies par exemple).













